铁死亡在疾病中的发病机制、生物学和作用
自2012年铁死亡一词被提出以来,铁死亡引起了人们的广泛关注。这种独特的细胞死亡程序由依赖铁的磷脂过氧化驱动,并受多种细胞代谢途径(包括氧化还原稳态、铁代谢、线粒体活性、氨基酸、脂质和糖代谢)和各种与疾病相关的信号途径的调节。
大多数器官损伤和退行性疾病都是由铁死亡引起的。耐药肿瘤细胞,特别是间充质状态的、易转移的肿瘤细胞,极易发生铁死亡。
因此,通过药理学调控诱导和抑制铁死亡在治疗耐药肿瘤、缺血性器官损伤等与广泛脂质过氧化相关的退行性疾病方面具有很大的潜力。

2021年,一篇发表在NATURE REVIEWS | MOLECULAR CELL BIOLOGY上的综述系统阐述了铁死亡的分子机制和调控网络,以及铁死亡在抑制肿瘤和免疫监测中的生理功能、病理作用和靶向治疗的潜力;讨论了一些重要概念和亟待解决的问题。这些是未来铁死亡研究的重点。简要介绍如下:
在引起细胞氧化应激的因素中,脂质双分子层中的脂质氧化修饰,特别是脂质过氧化,已成为决定细胞命运的重要调节因子。广泛的脂质过氧化细胞死亡的方式称为铁死亡。
脂质过氧化受到环境和基因的影响,包括热、辐射、代谢、氧化还原稳态和细胞间接触,以及致癌和肿瘤抑制信号。与引起铁死亡的因素一样,越来越多的证据表明铁死亡在肿瘤抑制和免疫中发挥着潜在的生理作用。
同时,铁死亡也影响某些真菌的发育和线虫的衰老。研究明确了铁死亡的病理生理关系,这在治疗肿瘤和预防器官缺血性损伤方面尤为重要。
从1950年到1960年,哈里·伊格尔观察到了这种类似铁的死亡现象。缺乏半胱氨酸可导致细胞死亡,内源性合成半胱氨酸可抵抗细胞死亡。半胱氨酸是减少谷胱甘肽(GSH)生物合成的限速因子。
对于谷胱甘肽的合成,半胱氨酸可以通过中性氨基酸转运体或X-c-胱氨酸/谷氨酸反向转运体(含有SLC7A11和SLC3A2亚单位的跨膜蛋白复合物,以下简称为X-c-系统)被氧化并从环境中吸收,或通过蛋氨酸和葡萄糖的转硫途径合成。
现有研究表明,GSH合成或增强的X-c-系统或活性GPX4可使多种细胞免受氧化应激,特别是在没有硫醇引起的细胞死亡的情况下,这些早期研究揭示了铁的死亡机制。
铁死亡的机制早期研究表明,X-c-系统-GSH-GPX4的铁死亡途径受到抑制,而过氧化磷脂(PLOOHs)是一种基于活性氧(ROS)形式的脂质,是铁死亡被抑制的关键。
已经发现了依赖GPX4的铁死亡监测途径,PLOOH的合成机制,特别是PLOOH前体多不饱和脂肪酸(PUFAs)的合成和激活也受到了广泛关注。
这些研究集中在细胞代谢方面,揭示了铁死亡与代谢途径之间的密切联系。GPX4是PLOOH的主要中和酶,其主流机制是erastin/RSL3诱导铁死亡。
这一机制说明GPX4-RSL3的失活直接诱导铁死亡,而erastin抑制胱氨酸的转移使细胞失去半胱氨酸,而半胱氨酸是GSH的基本细胞成分,间接诱导铁死亡。
PLOOHs的积累会对细胞膜造成快速且不可修复的损伤,导致细胞死亡。因此,这些研究将铁死亡定义为一种细胞死亡过程,其机制不同于其他已知的死亡过程。
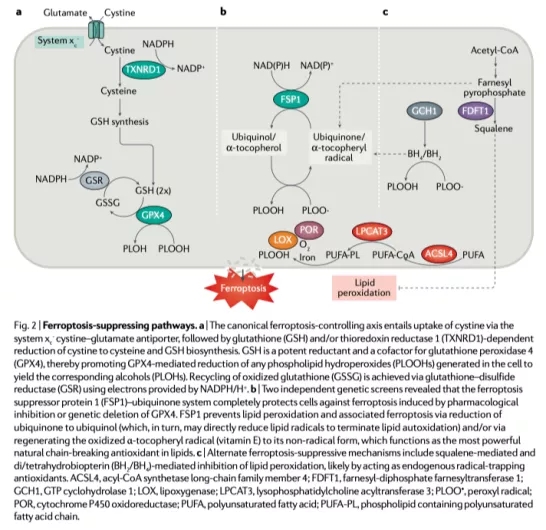
磷脂过氧化的驱动因素
无限制的脂质过氧化是铁死亡的特征。1950年的早期研究表明,微量元素硒、维生素E和半胱氨酸可能抑制脂质过氧化。
脂质过氧化的激活需要从磷脂(PUFA-PLs)中去除一个双烯丙基氢原子(位于两个碳碳双键之间),该磷脂含有脂质双分子层中的多不饱和脂肪酸酰基。然后形成以碳为中心的磷脂基团(PL•),再与氧反应生成磷脂过氧化氢自由基(PLOO•),并从另一个PUFA中除去一个氢形成PLOOH。
如果GPX4、PLOOH和脂质自由基(特别是PLOO•和烷氧基磷脂自由基PLO•)不能转化为相应的醇(PLOH),这些物质将通过在远端去除PUFA-PLs而被去除。氢原子反应生成PLOOH,与氧分子反应生成PLOOHs。
最终,这会产生许多产物,包括脂质过氧化物的分解产物(如4-羟基壬烯酸和丙二醛)以及氧化和修饰的蛋白质。
上一篇:中国农业大学生物学院 招聘与就业 生物学院周文
下一篇:CCTV报道:干细胞修复子宫内膜,让千万女性重获