2019年9月CRISPR/Cas最新研究进展
2019年9月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
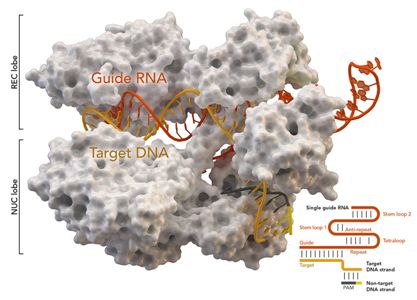
图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的9月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science:全文解读!开发出CRISPR LiveFISH技术,成功对活细胞中的DNA和RNA进行实时成像
doi:10.1126/science.aax7852
基因组编辑可以诱导包括易位在内的染色体重排。尽管测序方法已用于鉴定和描述与遗传疾病和基因编辑有关的染色体异常,但是染色体重排的时间动态变化鲜为人知。
之前的研究依赖于使用基因组整合的LacO/TetO阵列,这既枯燥又有挑战性。与荧光蛋白融合在一起的没有核酸酶活性的dCas9,或者招募单向导RNA(sgRNA)的与荧光蛋白融合在一起的RNA结合蛋白能够对基因组位点进行CRISPR介导的实时成像。但是,对编码CRISPR组件的DNA的需要限制了它的使用。传统的荧光原位杂交(FISH)需要DNA变性,同时在体外与sgRNA组装在一起的荧光标记dCas9(CASFISH)仅检测固定样本中的基因组位点,这就限制了实时追踪。
在一项新的研究中,来自美国斯坦福大学、卡斯迪加学校和中国浙江大学的研究人员报道了一种称为CRISPR活细胞荧光原位杂交(CRISPR live-cell fluorescent in situ hybridization, CRISPR LiveFISH)的实时成像方法,从而允许研究活细胞中的各种染色体功能。相关研究结果发表在2019年9月20日的Science期刊上,论文标题为“CRISPR-mediated live imaging of genome editing and transcription”。
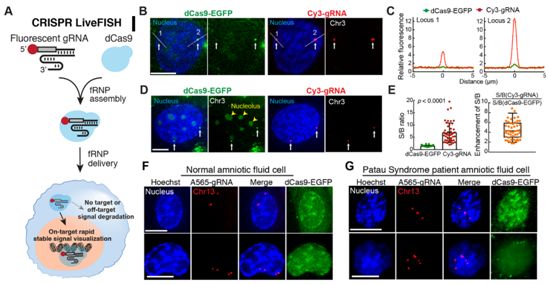
图片来自Science, 2019, doi:10.1126/science.aax7852。
这些研究人员报道了用于活细胞DNA和RNA成像的CRISPR LiveFISH技术。化学合成的荧光gRNA与dCas蛋白形成的复合物能够促进快速稳健地、可扩展地对细胞(包括原代细胞)中的基因组DNA进行追踪和对细胞中的RNA进行成像。在富含核糖核酸酶的环境中,对Cas9:gRNA:DNA三元复合物中gRNA的靶DNA依赖性保护会富集靶信号,同时让背景噪音最小化。CRISPR LiveFISH也允许对活细胞中内源性基因组位点上发生的CRISPR诱导的基因编辑和易位事件进行动态追踪。使用dCas9和dCas13系统的双DNA/RNA CRISPR LiveFISH能够对相同细胞中的基因组DNA和RNA转录本进行实时成像。人们有可能将CRISPR LiveFISH与其他的基因操纵技术(比如,CRISPRi/a、表观遗传修饰和CRISPR-GO)结合使用来加深对基因组组装和细胞核事件的时空动态变化的理解。
2.Science子刊:利用CRISPR/HDR技术进行工程化改造有望赋予杂交瘤抗体多样化的功能!
doi:10.1126/sciadv.aaw1822
如今,生物工程师和生命科学家能够结合杂交瘤技术来制造大量相同的抗体,同时还能开发出新型的抗体疗法和诊断技术,近年来该技术的临床前和临床研究都突出了抗体型别对于治疗效果的重要性。
单克隆抗体(mAb)的应用彻底改变了医学领域,其能用来治疗曾经科学家认为无法治愈的多种疾病。从1975年开始,杂交瘤技术被广泛应用于单克隆抗体的发现、筛选和生产,在过去10年里,科学家们为临床研究制造了大量杂交瘤,并对其进行了验证和发展,其中mAb的形式和型别对于理解其在临床前模型中的表现非常重要。基因工程所产生的mAbs通常采用重组技术进行生产,其中的可变结构域能进行测序、并且克隆到质粒中,在瞬态系统中进行表达;但这些过程比较耗时、具有挑战性且成本高昂,会严重阻碍临床前的研究进程。
在一项最新研究中,来自荷兰的研究人员开发出了一种多用途的CRISPR和同源定向修复(HDR)平台,其能够快速设计免疫球蛋白结构域并形成重组杂交瘤,其能够分泌设计抗体的首选格式、物种或亚型。研究人员认为,这种通用型的平台或将能够促进大规模抗体工程研究,助力科学家们进行临床前的抗体研究工作。
3.Nat Commun:新研究发现细菌中的CRISPR-Cas9防御系统
doi:10.1038/s41467-019-12244-z
借助高度先进的显微镜和同步加速器,哥本哈根大学的研究人员对细菌抵御其他细菌和病毒的分子机制提出了开创性的见解。相关结果发表在最近一期的《Nature Communications》杂志上。这一发现可能会成为将来与疾病作斗争的重要基石。
研究人员展示了被病毒攻击的细胞如何激活称为COA(环状寡聚腺苷酸)的分子,而COA则激活一种称为CSX1的蛋白复合物,以清除发起攻击的病毒。
“以通俗的说法,CSX1能够弱化入侵者的侵染力。一旦COA被激活,我们就能看到CSX1如何被激活,进行旋转并开始保护细胞免受感染。”诺和诺德基金会蛋白质研究中心的Guillermo Montoya教授解释说。
哥本哈根大学的研究人员还成功地激活了这一过程。他们给这种蛋白复合物提供COA分子,从而启动了防御机制。“简而言之,我们发现了一个开关,可以在我们需要的时候开启细胞的防御系统,这样我们就可以消除潜在的攻击,”Montoya教授说道道。
4. Nat Biotechnol:新型纳米胶囊高效输送Cas9核糖核酸蛋白复合物用于体内基因组编辑
doi:10.1038/s41565-019-0539-2
编辑遗传密码的新工具为遗传性疾病、某些癌症甚至顽固病毒感染的新疗法带来了希望。但是,将基因疗法传递到身体特定组织的典型方法可能是复杂的,并可能导致令人不安的副作用。威斯康辛大学麦迪逊分校的研究人员通过将基因编辑有效载荷装入可定制的微型合成纳米胶囊中解决了其中的许多问题。近日他们在《Nature Nanotechnology》杂志上描述了这种新型的递送系统。
威斯康辛大学麦迪逊分校生物医学工程教授、全美基因组编辑协会指导委员会联席主席Krishanu Saha表示:"在注射基因疗法后,编辑体内错误的组织是一个严重的问题。"该协会得到了美国国立卫生研究院(National Institutes of Health) 1.9亿美元的资助。"如果生殖器官被无意中编辑了,那么病人就会把编辑的基因遗传给他们的孩子和后代。"
Gong的实验室将基因治疗的有效载荷--也就是基因编辑工具CRISPR-Cas9的一个版本,用Saha实验室设计的导向RNA--包裹在一个薄的聚合物外壳上,形成一个直径约25纳米的胶囊。纳米胶囊的表面可以装饰有多肽等官能团,使纳米颗粒能够靶向某些细胞类型。
纳米胶囊在细胞外保持完整--例如,在血液中--只有在目标细胞内被一种叫做谷胱甘肽的分子触发时才会分裂。然后,释放的有效载荷移动到细胞核,编辑细胞的DNA。由于纳米胶囊在细胞细胞质内的寿命较短,因此有望减少意外的基因编辑。
5.Nat Biotechnol:构建出具有自我编辑活性的DNA碱基编辑器
doi:10.1038/s41587-019-0236-6
在一项新的研究中,Julian Grünewald等人描述了对SECURE-BE3变体进行结构引导的改造,其中SECURE-BE3变体具有下降的脱靶RNA编辑活性和可比较的在靶DNA编辑活性,也是迄今为止描述的最小酿脓链球菌(Streptococcus pyogenes)Cas9碱基编辑器之一。相关研究结果发表在2019年9月的Nature Biotechnology期刊上,论文标题为“CRISPR DNA base editors with reduced RNA off-target and self-editing activities”。
上一篇:[年报]博晖创新:2019年年度报告摘要
下一篇:瑞士开发可在多人场合快速检测空气中新冠病毒的生物传感器