基于CRISPR技术和水动力尾静脉注射建立肝脏特异
本发明属于生物技术领域,具体涉及基于crispr技术和水动力尾静脉注射建立肝脏特异性敲除小鼠模型的方法。
背景技术:
crispr基因修饰动物(包括人源化动物)是研究生物医学领域中的分子机理和致病机制的重要研究手段。传统的转基因动物制作方法需要得到相应动物的干细胞,显微注射改造的遗传物质后将干细胞植入囊胚,直至生产出嵌合型动物,并通过杂交最终得到纯合型动物(terryvandyke,t.j,2002)。由于转基因动物传统制备的复杂性,近年来,具有序列特异性的核酸酶广泛应用于动物的基因组定点修饰,其中,zfn和talen是两种最常见的基因编辑技术,zfn和talen系统均基于蛋白质工程,构建基因(编码特异性结合靶基因的蛋白)较困难,而且由于切割时以二聚体的形式发挥作用,需要成对设计,技术难度较大,构建组装时间较长(kim,h.andj.s.kim,2014)。而crispr/cas系统,是细菌特有的一种获得性免疫系统,研究人员将其改造成为靶向基因组编辑的工具,由于操作简单、成功率高且效率高,成为了靶向基因组编辑工具中的佼佼者(gasiunas,g.,etal.2012.)。crispr/cas技术已经在基因功能研究、动物模型建立、基因治疗等领域得到广泛的推广和应用,国内外研究表明,应用crispr/cas系统构建小鼠动物模型为全身性敲除。
水动力基因转移技术是一种简便、高效的体内基因转染方法,近年来已有成熟地发展。它是在高压下经小鼠尾静脉快速注射含目的基因重组质粒的生理盐水,从而在小鼠体内(主要在小鼠肝脏)实现目的基因的高效表达,常用于动物实验和实验动物的造模。
技术实现要素:
针对现有技术存在的问题,本发明的目的在于设计提供一种基于crispr技术和水动力尾静脉注射建立肝脏特异性敲除小鼠模型的方法技术方案。
所述的基于crispr技术和水动力尾静脉注射建立肝脏特异性敲除小鼠模型的方法,其特征在于在aav-gfp肝脏特异性表达小鼠模型中通过水动力尾静脉注射输送crispr系统px330-sggfp建立肝脏特异性敲除小鼠模型。
所述的基于crispr技术和水动力尾静脉注射建立肝脏特异性敲除小鼠模型的方法,其特征在于所述的aav-gfp肝脏特异性表达小鼠模型是aav-gfp病毒液经尾静脉高压水动力注射的方法感染小鼠肝细胞而建立的小鼠模型。
所述的基于crispr技术和水动力尾静脉注射建立肝脏特异性敲除小鼠模型的方法,其特征在于所述的crispr系统px330-sggfp由px330质粒的多克隆位点basi插入sggfp得到。
所述的一种肝脏特异性敲除小鼠模型,由任一上述记载的方法制备获得。
所述的一种肝脏特异性敲除小鼠模型,其特征在于所述的小鼠为雌性7-8周龄fvb/nj小鼠。
本发明与现有技术相比,具有以下优点:为了解决真核质粒转染的瞬时表达的问题,以及慢病毒转染体系病毒滴度低转染效率低下的问题,本发明特别利用aav-gfp病毒液通过小鼠尾静脉水动力注射建立肝脏特异性稳定表达gfp小鼠模型,达到稳定高效率的肝脏特异性表达目的基因。在此模型基础上,进一步使用crispr/cas9系统进行gfp肝脏特异性敲除模型构建,建立小鼠肝脏特异性的快速基因敲除模型。crispr/cas9基因编辑技术操作简单且效率高,但由于crispr/cas9系统敲除动物模型为全身性敲除,本发明利用高压尾静脉水动力技术输送crispr/cas9系统特异性到动物肝脏表达,从而实现crispr/cas9系统的靶向组织特异性敲除的功能。本发明不仅可以针对性使用crispr/cas9系统进行肝脏特异性的模型研究,而且可以为肝脏重大疾病和新药研发提供高水平的动物模型。
附图说明
图1为pegfp-n1(cmv-gfp)质粒结构示意图;
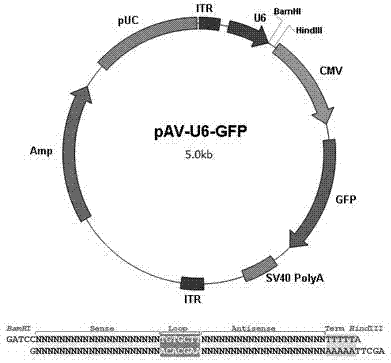
图2为aav-gfp质粒结构示意图;
图3为aav-gfp肝脏特异性表达成像检测;
图4为crispr/cas9系统示意图;
图5为px330-sggfp质粒结构示意图;
图6a、6b为注射aav-gfp/px330-sggfp肝脏特异性敲除表型观察,其中图6a.为注射3天(72h)后生理盐水组和aav-gfp组肝脏特异性表达,图6b.为注射aav-gfp/px330-sggfp肝脏特异性敲除。
图7px330-sgpten-sgp53-cas特异性敲除对肝组织病理的影响。
具体实施方式
以下通过实施例进一步说明本发明。
实施例1:真核表达载体pegfp-n1的建立
材料及来源:质粒pegfp-n1来源于clontech(genbankaccession#u55762catalog#6085-1),由本室保存,pegfp-n1(cmv-gfp)质粒结构如图1所示。质粒小提试剂盒购自omega公司,质粒大提提取试剂盒购自axygen公司。
方法:活化质粒pegfp-n1甘油菌,用质粒大提提取试剂盒获得大量真核表达egfp质粒1mg。
实施例2:腺相关病毒表达载体aav-gfp的建立
上一篇:双高基因工程实训室智慧化建设项目更正公告
下一篇:大连理工大学主页平台管理系统 肖义