一种重组蛋白肽图分析方法与流程
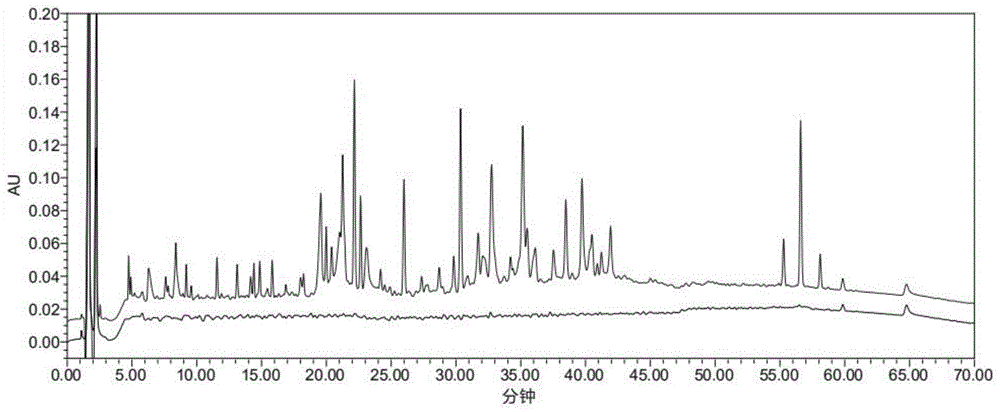
本发明属于肽图分析技术领域,具体为一种重组蛋白肽图分析方法。
背景技术:
肽图分析(peptidemapping)是蛋白多肽药物质量控制的重要手段之一,是根据蛋白的分子量大小以及氨基酸组成特点,利用酶裂解法或化学裂解法,将蛋白质大分子裂解成较小片段,并通过一定的分离检测手段形成特征性图谱的过程。它对于蛋白质类药物结构研究和特性鉴别具有重要意义,已成为蛋白多肽类药物质量标准控制的常规指标之一。
对于重组蛋白质药物的肽图检查,2015年版《中国药典》三部采用的方法一般为trypsin裂解-反相高效液相色谱法,早期本项目的肽图谱分析直接按照药典的方法进行,虽然单次实验样品与对照品肽图谱具有较好的一致性,但其肽图谱部分峰分离度明显不够,而且不同时间实验得到的峰谱存在一定的差异,认为是由于此重组蛋白分子结构复杂,由多条肽链组成,且链间及链内含有多对二硫键,按中国药典直接进行胰酶裂解和常规梯度洗脱,因结构位阻效应和片段较多,很难酶解充分并得到理想的裂解峰图,为此,发明人综合各方面因素提出了一种重组蛋白肽图分析方法。
技术实现要素:
本发明的目的在于:为了解决背景技术涉及的技术问题,提供一种重组蛋白肽图分析方法。
本发明采用的技术方案如下:
一种重组蛋白肽图分析方法,包括如下步骤:
s1、样品配制:包括s101、取重组蛋白对照品和待测样品,超纯水溶解或稀释,使终浓度为1mg/ml;s102、胰蛋白酶溶液:称取胰蛋白酶5mg,超纯水溶解,浓度为1mg/ml,分装于ep管中,50μl/管,-20℃储存备用;s103、100mmol/lnh4hco3溶液,称取nh4hco3395.3mg,超纯水溶解并定容至50ml;s104、10%tfa溶液:取tfa溶液100μl于ep管中,加入900μl超纯水,混匀,备用;
s2、配制平衡色谱柱的流动相组;
包括s201、配制流动相a:100%超纯水(含0.1%tfa)溶液:取洁净量筒,量取超纯水1000ml于蓝盖瓶中,加入tfa1.0ml,混匀,超声30min,备用。
s202、流动相b:90%乙腈(含0.1%tfa)溶液:取洁净量筒,量取乙腈900ml,超纯水定容至1000ml,加入tfa1.0ml,混匀,超声30min,备用。
s203、流动相c:100%乙腈,取适量乙腈(约500ml),超声30min,备用;
s204、流动相d:100%超纯水,取适量超纯水(约500ml),超声30min,备用;
s3、样品处理:取洁净1.5mlep管,加入100mmnh4hco3溶液200μl,待测样品200μl,同时做标准对照和空白对照,混合均匀后于100℃沸水浴加热30min;加热完毕后取出至4℃冰箱冷却5min,按照酶底比1:50,加入4μl胰蛋白酶溶液,混合均匀于恒温水槽37℃反应1h;然后加入20μl10%tfa溶液终止反应,混合均匀后离心处理,并取上清液150μl于液相进样瓶中,待hplc进样分析;
s4、hplc检测,包括s401、hplc设备开启:预先冲洗色谱柱,然后用初始洗脱流动相a平衡色谱柱20min至基线平稳,备用;
s402、样品检测:按照下色谱条件首先平衡色谱柱80min,然后进样检测;
s5、结果处理:将对照品及供试品图谱进行重叠比较,保存结果;
s6、结果判定,空白对照在4~60min之间应无明显吸收峰,待测样品应与对照品肽图谱一致,则待检样品合格,反之不合格。
作为本发明进一步技术方案:s3、样品处理中离心处理,采用离心机,且转速为10000rpm离心10min。
作为本发明再进一步技术方案:所述s401中按照《waterse2695型高效液相色谱仪标准操作规程》开启仪器并完成溶剂管理系统准备,连接所需色谱柱。
作为本发明再进一步技术方案:所述s401中预先冲洗色谱柱,用50%超纯水-50%acn冲洗色谱柱10min,流速为1ml/min。
作为本发明再进一步技术方案:所述s402中色谱条件:色谱柱,symmetry300tmc18(5μm,4.6×150mm);柱温,30±5℃;流速,1ml/min;检测波长,214nm;进样体积,80μl;运行时间,76min。
作为本发明再进一步技术方案:所述s5中重叠条件:90度重叠,间距为0。
作为本发明再进一步技术方案:还包括s7、检测后处理:样品检测结束后,用下色谱洗脱方法冲洗色谱柱,然后用100%acn冲洗hplc四管路,确保各管路冲洗干净后,关闭仪器和电源。
作为本发明再进一步技术方案:所述色谱柱一周内不再使用则拆下色谱柱,至于阴凉处妥善保存;用两通连接设备管路。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
1、本发明针对重组人红细胞生成素(fc)融合蛋白,经过对变性、二硫键断裂、色谱条件等的优化,建立了一种稳定、可控的肽图谱分析方法用于rhepo-fc的质控。
2、本发明重点解决了因结构位阻效应和片段较多,很难酶解充分并得到理想的裂解峰图的技术问题,提高重组蛋白质药物的肽图检查准确性。
附图说明
图1为本发明的hplc分析重组人红细胞生成素(fc)融合蛋白放大肽图。
具体实施方式
上一篇:上海药物所在复杂糖肽合成方面取得进展
下一篇:应用质谱扫描测定胸腺肽相对分子质量,论文,期刊