中国首个干细胞药物有多远?
随着全球老龄化趋势的不断加重,退行性疾病的发病率日趋上升,催生了以干细胞技术为核心的再生医学。细胞药物被认为是继化学药物、抗体药物之后的第三代药物。目前,全球共批准数十种细胞治疗产品,其中严格意义上的干细胞药物不到十种(某些细胞产品属于体细胞,例如软骨细胞、表皮细胞)。
全球批准上市的干细胞药物
截至目前,全球共批准8个干细胞药物,其中韩国就占了4席。另外,2012年在加拿大和新西兰获批的Prochymal和2016年在日本上市的Temcell基于相同的技术,由Osiris授权给JCR相关技术。目前,Osiris的Prochymal项目已经出售给Mesoblast。值得一提的是,Prochymal在美国的III期临床没有达到预期目标,导致其无法在美国上市。同样的技术却可以先后获得加拿大、新西兰和日本的批准,侧面反映不同国家对干细胞药物上市准入门槛的不同。
目前全球批准上市的干细胞药物都采取加速审批的方式,一般在做完II期临床后就获批。这种获批方式一般是有限批准,5年左右后要接受重新审批,以决定是否可以继续销售。前段时间,全球首个获批的干细胞药物Hearticellgram-AMI就面临这样的考验,而舆论并不看好,目前官方审批结果并未公布。

全球首例干细胞治疗药物Hearticellgram-AMI
抛开审批方式和疗效不谈,即使对于已经上市的干细胞药物,大部分的市场前景并不光明。除去Prochymal系列产品,另外5个干细胞药物中只有Cartistem是异体来源的细胞,市场表现也最好。自体细胞制备意味着漫长的生产周期、难以均一化的质量标准及高昂的成本,这些对于一个成功的产品来说都是致命的缺陷。Anterogen公司目前正在开发Cuepistem的异体版本,就是出于这种考虑。
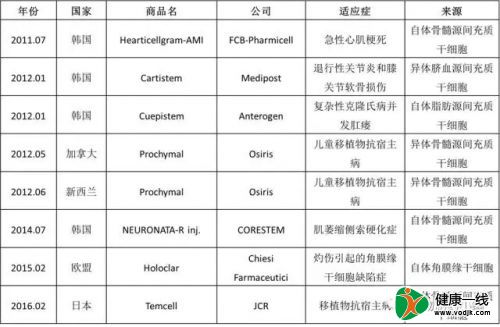
全球已上市的干细胞药物
中国干细胞药物难以突破的原因
对于再生医学这样一个新兴领域,中国起步得不算太晚。相比其他领域来说,和国际先进水平的差距较小,某些方向甚至走在世界的前列。从Pubmed的发表论文数量来看,过去5年来(自2017年8月16日往前推),关于干细胞研究的文献有61899篇,其中属于美国的有13193篇,中国的有12644篇,比美国略低,占比超过20%。
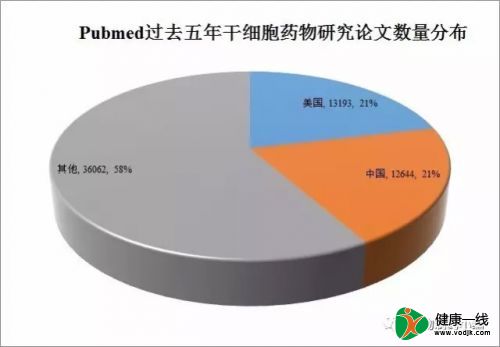
过去十几年来(尤其是2015年之前的几年),中国关于干细胞临床应用的监管一直处于令出多门的局面。SFDA和卫计委各自发布相关规定,行业的反应不出意料地选择容易走的路。
早在1999年5月26日,SFDA就出台了《新生物制品审批办法》,并在2002年10月30日颁布的《药品注册管理办法》(试行)(局令第35号)中正式将体细胞列为生物制品三类新药。这个规定在《药品注册管理办法》的历次修订中一直沿用至今。因此,SFDA对于干细胞上市途径的态度一直未变,即按照生物制品三类新药申报。
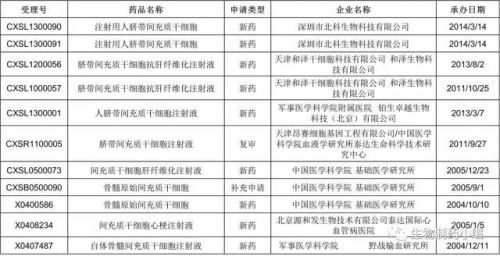
据SFDA药品审评中心官网的检索结果,截至目前共受理11个干细胞药品申报(不含申报后撤消),主要是脐带和骨髓来源的间充质干细胞注射液,适应症包括肝纤维化、心梗等。最早的申报可追溯到2004年10月10日中国医学科学院基础医学研究所申报的“骨髓原始间充质细胞”。另外,根据SFDA药品审批中心药物临床试验登记与信息公示平台的检索结果,骨髓原始间充质细胞共开展3项药物临床试验(CTR20132003、CTR20132698、CTR2013202),适应症包括移植物抗宿主病和急性心梗,最后一项也于2011年完成。但上述11个干细胞药物申报均未进入审批程序,让人不禁疑惑接下来十多年发生了什么。
SFDA干细胞药品申报情况
卫计委方面,在2000年10月24日颁布的《全国医疗服务价格项目规范(试行)》2001版中,CIK免疫细胞治疗列入其中,为收费提供了法律依据。在2009年6月11日颁布的《首批允许临床应用的第三类医疗技术目录》中,自体免疫细胞和干细胞都列入其中,干细胞事实上也取得合法上市的地位。相关企业自然没有动力投入资金开展干细胞药物研发的工作,为后来干细胞临床应用的乱象埋下隐患,以致2011年12月26日颁布了《关于开展干细胞临床研究和应用自查自纠工作的通知》,紧急叫停干细胞临床研究。2015年6月29日,卫计委颁布《关于取消第三类医疗技术临床应用准入审批有关工作的通知》,将主体责任下放到医疗机构。没有了政府部门的背书,加上2016年曝光的“魏则西”事件,终结了细胞治疗收费的时代。一切又回到原点。
上一篇:美实验人员用细菌产出乙酸
下一篇:新发现:免疫细胞有助于开发慢性肺炎疗法