瑞德西韦从临床试验到正式用药需多久?专家解
许付
在临床试验中,瑞德西韦在本次新冠疫情防治中,能否作为特效药有效治愈感染新冠病毒的患者,抑制疫情的蔓延,我们拭目以待。
最近,随着中国抗击新型冠状病毒肺炎疫情的深入,有一款叫瑞德西韦(Remdesivir)的药火了,围绕这一名字的谣言也开始多了起来。
最新的一个谣言是,说这款药在武汉确诊患者中试用,因为效果好,所以国家准备取消相关临床流程,直接启动“同情用药”,开始在患者身上广泛使用。
跟这个谣言相关的是,说有700余例患者,因为用了这药全部显效,24小时96%的肺部感染都奇迹般恢复了。传言还称,第二批、第三批患者已经准备就绪。
诸如此类的谣言还很多,各种变换花样,这一方面反映了一些人的急迫心态,另一方面也反映一些人对药物临床试验的程序不了解。
针对互联网上流传的抗病毒药物瑞德西韦在武汉“显效”的传闻,正在武汉负责该药物临床试验的中日友好医院副院长曹彬教授对媒体表示,“临床研究今天(2月6日)才开始,怎么可能知道结果?”他强调,科学研究需要时间。
瑞德西韦是一款美国吉利德公司(Gilead)的在研广谱抗病毒药物,是一种核苷类似物前药。目前在刚果(金)开展治疗埃博拉出血热的Ⅱ和Ⅲ期临床研究,尚未在全球任何国家获得批准上市。
那么,这款药来到中国,如果从注册申报,到临床试验,需要多长流程才能成为正式用药呢?
从注册申报到临床批准,只用了三天时间
新药研发是一个漫长的过程,从药物筛选到上市,一般需要经过10年甚至更长的时间。一般药品开展临床试验,需要完成药学研究和药理毒理研究,并向国家药品监督管理局药品审评中心(CDE)提交临床试验注册申报资料,按正常流程需要经过60个工作日的技术审评,如CDE未提出否定或质疑意见,申请人可以按照方案开展药物临床试验。
但对于突如其来的新型冠状病毒疫情,按传统的新药研发和注册申报,已无法满足当前疫情防治对药物的需求。关于在重大突发公共卫生发生时,国家对于用于防治疫情的新药注册申报是什么样的呢?
根据2017年12月28日国家食品药品监督管理总局(CFDA)发布的《总局关于鼓励药品创新实行优先审评审批的意见》,在公共健康受到重大威胁情况下,对取得实施强制许可的药品注册申请,予以优先审评审批。公共健康受到重大威胁的情况和启动强制许可的程序,由国家卫生计生委会同有关部门规定。对于突发公共卫生事件应急处理所需药品的注册申请,将按照有关规定程序办理。
另外,2019年12月10日,CFDA发布了《药品注册管理办法(征求意见稿)》,在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,CFDA可以依法决定对突发公共卫生事件应急所需防治药品实行特别审批。对纳入特别审批程序的药品,可以根据疾病防控的特定需要,限定其在一定期限和范围内使用。
目前,现行的药品特别审批法规为2005年11月18日国家药监局发布的《国家食品药品监督管理局药品特别审批程序》,药品特别审批程序启动后,突发公共卫生事件应急所需防治药品的注册申请统一由CFDA负责受理。注册申请受理后,CFDA应当在24小时内组织对注册申报资料进行技术审评,技术审评工作完成后,CFDA应当在3日内完成行政审查,作出审批决定,并告知申请人。
CFDA决定发给临床试验批准证明文件的,应当出具《药物临床试验批件》;决定不予批准临床试验的,应当发给《审批意见通知件》,并说明理由。
通过国家药监局和药品审评中心网站可以了解到,瑞德西韦的临床试验注册申报信息,总结如下:
2020年2月2日,吉利德和中国医科院药物作为进口药品联合申报临床试验。
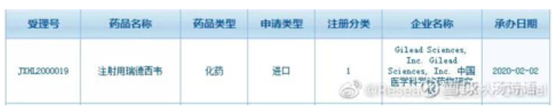
但不知何种原因,注册受理号从JXHL2000019变成了CXHL2000038 ,从代表进口的J变成了代表国产的C ,申报者只有中国医科院药物所。但目前,编者登录CDE官网时,已查不到瑞德西韦的相关受理信息。
上一篇:中日友好医院辟谣:瑞德西韦临床试验结果未出
下一篇:现场视频!瑞德西韦临床试验启动