从pKa到流动相pH的科学选择
由于Ka的值可以非常小(10-50)或者非常大(1012),范围跨度很大,因此使用起来不方便。为了方便起见,定义了pKa来表示酸的酸性强度:
pKa越小,酸性越强;反之,酸性越弱。pKa的大小和化合物本身的结构有关,也和溶剂有关,比如在水中测到的pKa和在DMSO中测到的就不一样(后面还会详细介绍到当配置流动相时,有机溶剂加入缓冲液后引起pKa和pH的变化)。
相应的,碱性化合物的电离常数为Kb,也有用Kb的负对数pKb表示碱性强度。由于Kb与它的共轭酸的电离常数Ka的乘积为常数,因此一般用它们的共轭酸的pKa表示其酸碱性,其共轭酸的pKa越大,碱性越强,反之碱性越弱。
pH: 氢离子浓度指数,即:
大部分的用反相色谱分析的化合物都具有一些可离子化的官能团,比如羧基(-COOH)、磺酸基(-SO3H)或者氨基(-NH2)。而在反相色谱中,样品的保留情况和其官能团的离子化状态关系密切,中性态和离子态之间的保留时间往往可以有高达30倍的差异。因此如果想要获得好的色谱选择性和保留重复性,对离子化程度的各种影响因素的理解就很重要。
可离子化的分析物的反相保留取决于它们的离子化程度,一般离子化程度越高,在反相固定相(如C18)上的保留越弱,在中性状态时保留最强。而分析物的离子化程度取决于流动相的pH值和分析物的pKa值,因此保留时间也就取决于流动相的pH和分析物的pKa。
对于酸性和碱性分析物,其保留因子和流动相pH的关系图为:
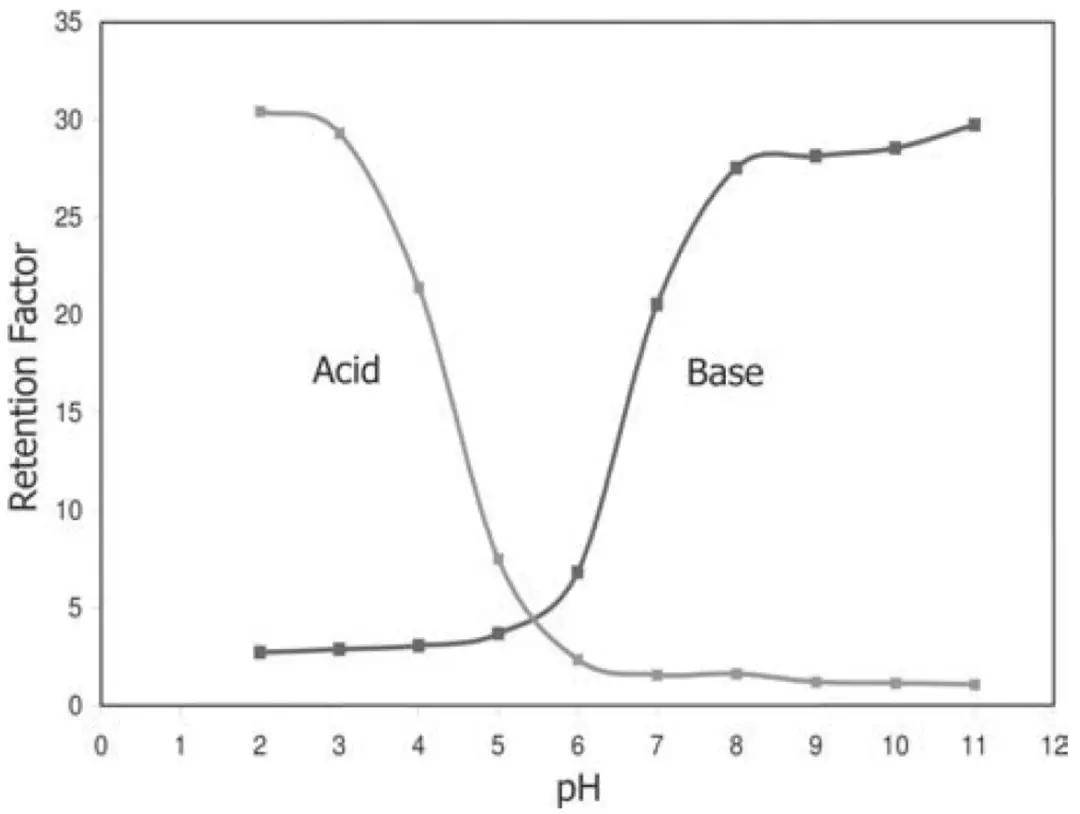
即酸性条件(低pH值)有利于酸性分析物的保留,而碱性条件有利于碱性分析物的保留。且在pH大于或者小于某个值时,保留因子不随pH的变化而变化,而在这两个阶段中间,保留取决于离子化程度:
这里k表示分析物的保留因子,k0是分析物的质子化(即分子态)时的保留因子;k1是分析物去质子化(即离子态)时的保留因子;d是去质子化的程度:
这个方程里的pH是指流动相的实际的pH,pKa是化合物在这种流动相条件下的pKa。
对于同时带有酸碱基团的化合物来说,两性离子状态(即既带有正电荷,又带有负电荷)的保留比只带有一种电荷时保留要弱,因为其离子化程度更高。比如说对于一些氨基酸,在等电点时保留最弱。这种化合物的保留因子和流动相pH的关系图如下:
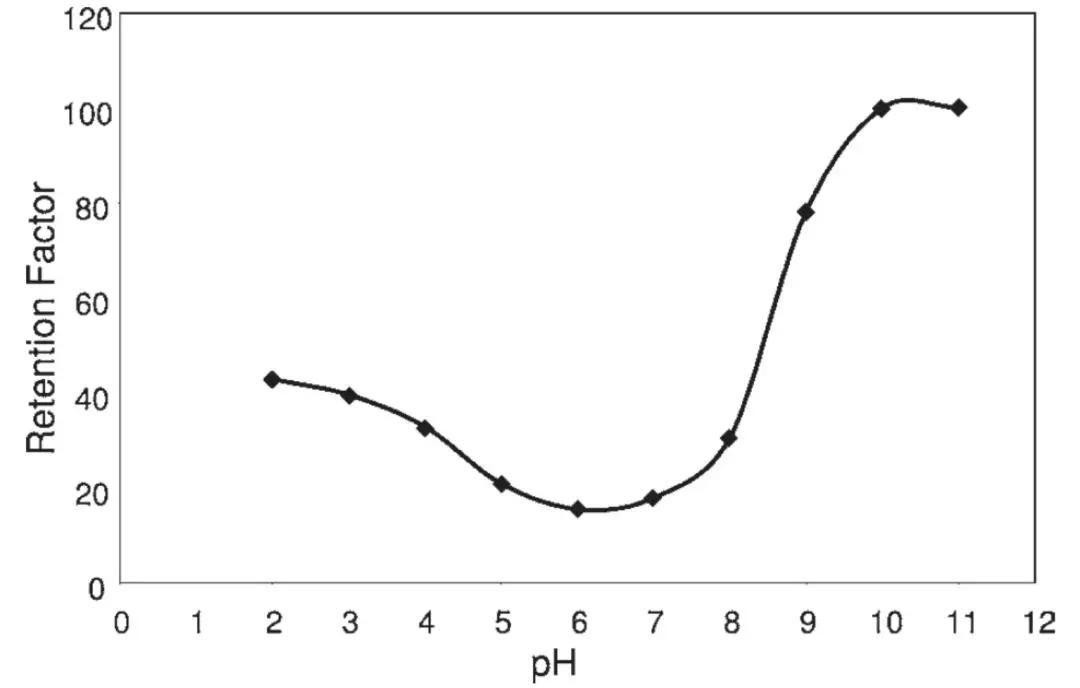
因此可以说,分析物的pKa决定了化合物的保留情况变化的pH范围。如果pH值在化合物的pKa的±2个单位之外,分析物会99%呈现电离态或者未电离态。这意味着这个区间之外保留时间不随pH的变化而变化;然而在这个区间之内,特别是pKa的±1.5个单位之间,保留时间随着pH的变化非常明显,这意味着要获得重复性好的保留时间,在实际操作中对pH进行严格的控制非常有必要。
pKa的确定或预测
既然pKa那么重要,我们怎么才能获得分析物的pKa值呢?
第一,对于已知化合物,我们可以通过一些数据库进行查询。在这里比较推荐两个开放的数据库,一个是英国RSC的,这是一个通用型的数据库,收录的化合物类型也比较广;另一个是针对于药物分子数据的加拿大数据库,只要输入目标化合物的CAS号或者英文名,就很可能可以在这两个数据库上查到相关信息。
第二,假如我们没办法在数据库中查到相关信息,我们可以根据一些已知数据进行预测。对于一些典型的化学物,我们应该熟知它们的pKa。最常见的脂肪族羧酸pKa值约为5,比如布洛芬的pKa为5.2;典型的胺类化合物的pKa约为9,比如阿米替林的pKa是9.4。这样在分析一些酸碱性的问题时就可以信手拈来,方便快捷。如果要尽量准确地预测一个新化合物的pKa,这就是一个比较系统的工程,因为一般一个化合物的pKa除了与它的关键基团如羧基、氨基等有关,还和这些基团所连接的其他结构有关,因此最好以结构尽量类似的已知化合物的pKa为基础进行预测。下面摘取了《Modern Physical Organic Chemistry》中常见结构的酸碱化合物在水溶液中的pKa:
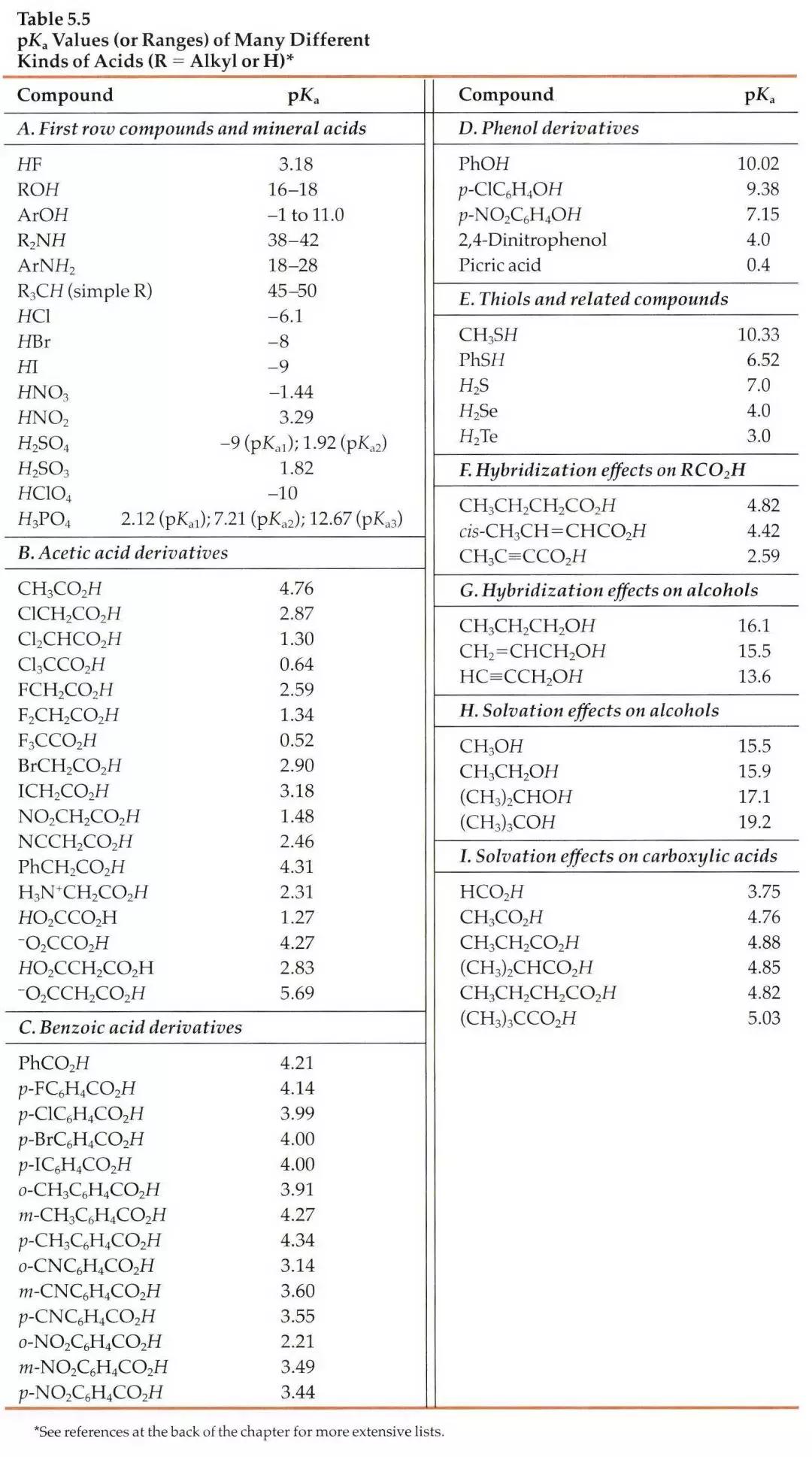
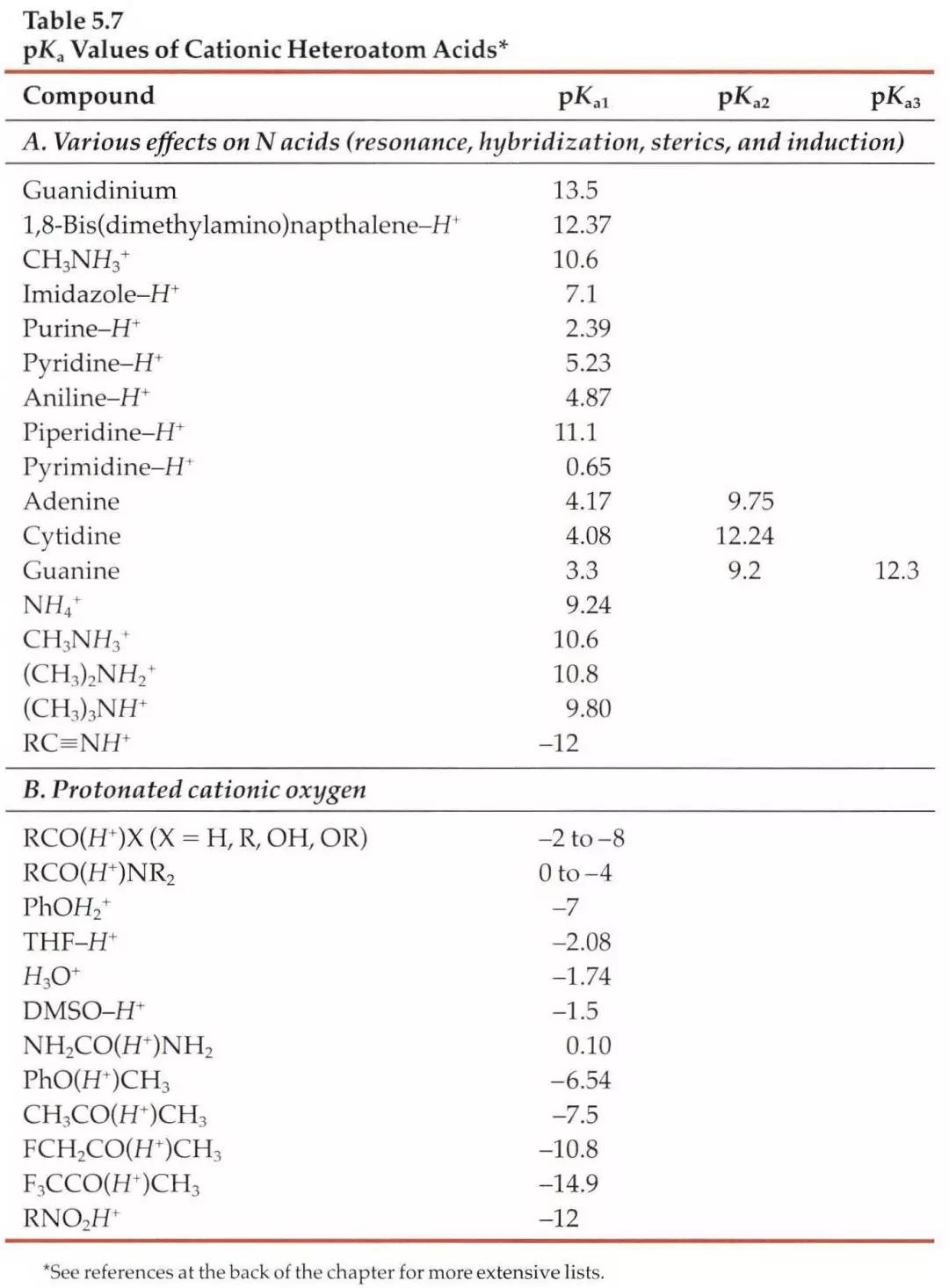
二、缓冲液
基本概念
上一篇:苏州化工废水处理设备产品操作步骤说明
下一篇:诺禾致源李瑞强:在基因测序的“好赛道”上行稳致远