新贝(上海)巴西vs瑞士让球 有限公司
聚合酶链反应(PCR)是分子生物学中广泛使用的一种方法,可以快速使特定DNA样品复制数百万至数十亿个拷贝,从而使科学家能够提取非常少的DNA样品并将其扩增到足以进行详细研究的数量。PCR由Kary Mullis于1983年发明。它是许多基因检测的基础,包括分析古代DNA样本和鉴定传染原。使用PCR可以在一系列或一系列温度变化中以指数方式扩增非常少量的DNA序列的拷贝。现在PCR是医学实验室和临床实验室研究中使用的常见且经常不可缺少的技术,可用于包括生物医学研究和刑事法医学在内的多种应用。绝大多数PCR方法依赖于热循环。热循环使反应物经受重复的加热和冷却循环,以允许进行不同的温度依赖性反应,特别是DNA熔解和酶驱动的DNA复制。 PCR使用两种主要试剂–引物(一种短的单链DNA片段,称为寡核苷酸,是与目标DNA区域的互补序列)和一种DNA聚合酶。随着PCR的进行,生成的DNA本身将用作复制模板,从而启动链式反应 ,在原始反应中,原始DNA模板被指数扩增。
几乎所有的PCR应用都使用热稳定的DNA聚合酶,例如Taq聚合酶, Taq聚合酶最初是从嗜热细菌水生栖热菌(Thermus aquaticus)中分离出来的。 如果所使用的聚合酶是热敏感的,它将在变性步骤的高温下变性。在使用Taq聚合酶之前,必须在每个循环中手动添加DNA聚合酶,这是一个繁琐且昂贵的过程。
该技术的应用包括用于测序的DNA克隆,基因克隆和操作,基因诱变; 基于DNA的系统发育的构建或基因的功能分析; 遗传疾病的 诊断和监测 ; 古代DNA的扩增;用于DNA分析的遗传指纹分析(例如法医科学和亲子鉴定);传染病诊断用核酸检测中病原菌的检测。
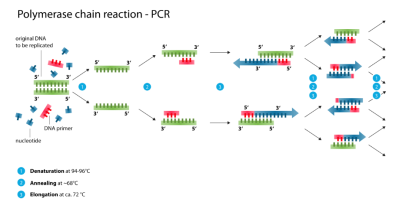
通常,PCR由一系列20–40次重复的温度变化(称为热循环)组成,每个循环通常由两个或三个离散的温度步骤组成(请参见上图)。大多数PCR方法共有的单个步骤如下:
初始化:只有需要通过热启动PCR进行热激活的DNA聚合酶才需要执行此步骤。包括将反应室加热到94–96°C或98℃(如果使用极热稳定的聚合酶),然后保持1 – 10分钟。
变性:这是第一个常规循环事件,包括将反应室加热到94–98°C,20–30秒。这会通过破坏互补碱基之间的氢键,导致双链DNA模板的DNA解链变性,从而产生两个单链DNA分子。
退火:反应温度降低到50–65°C,持续20–40秒,从而允许将引物退火至每个单链DNA模板。引物本身是单链序列,但比靶区域的长度短得多,仅在每条链的3'末端仅互补非常短的序列。
确定退火步骤的合适温度至关重要,因为效率和特异性会受到退火温度的强烈影响。 该温度必须足够低以允许引物与链杂交 ,同时必须足够高以使杂交具有特异性,即引物应仅与链的完全互补部分结合,而无其他结合。 如果温度太低,则引物可能会结合不好。 如果太高,引物可能根本不结合。典型的退火温度比使用的引物的T m低约3-5°C。仅当引物序列与模板序列非常匹配时,互补碱基之间才会形成稳定的氢键。在此步骤中,聚合酶与引物-模板杂交体结合并开始DNA形成。
延伸:此步骤的温度取决于所用的DNA聚合酶。Taq(Thermus aquaticus)聚合酶的热稳定DNA聚合酶的最佳活性温度约为75–80°C,尽管通常延伸温度为72°C。在此步骤中,DNA聚合酶通过从反应混合物中添加与模板互补的5'至3'方向的游离dNTP,从而合成与DNA模板链互补的新DNA链,从而使5'- 磷酸基团缩合。在新生(延伸)DNA链末端带有3'- 羟基的dNTP的数量。延长所需的精确时间取决于所用的DNA聚合酶和要扩增的DNA靶区域的长度。 根据经验,大多数DNA聚合酶在最佳温度下每分钟聚合一千个碱基。 在最佳条件下(即,由于底物或试剂的限制而没有限制),在每个延伸/延伸步骤中,DNA靶序列的数量都会加倍。在每个连续的周期中,原始模板链加上所有新生成的链成为下一轮延伸的模板链,从而导致特定DNA靶区域的指数扩增。
变性,退火和延伸过程构成一个循环。 需要多个循环才能将DNA靶扩增到数百万个拷贝。 在给定的循环数之后,用于计算形成的DNA拷贝数的公式为2n,其中n为循环数。因此设定为30个循环的反应将产生原始双链DNA靶区域的230或1073741824拷贝。
最终延伸:此步骤是可选的,但要在70-74°C的温度(PCR中使用的大多数聚合酶最佳活性所需的温度范围)下进行5-15分钟。最后一个PCR循环,以确保所有剩余的单链DNA被完全拉长。
最终保存:最后一步将反应产物无限期冷却至4–15°C,可用于PCR产物的短期保存。
上一篇:西班牙单日死亡病例数降至两月来最低值
下一篇:日本新增新冠肺炎确诊病例31例,累计确诊16367例