2017年度巨献:结构生物学重磅级研究TOP25解读
2017年12月31日/生物谷BIOON/---时光总是匆匆而逝,12月份即将结束,2017年也接近尾声,迎接我们的将是崭新的2018年,2017年科学家们在结构生物学领域依然取得了许多重磅级的研究成果,本文中小编对2017年结构生物学领域的重磅级亮点研究进行盘点,分享给大家!与各位一起学习!
1.Nature:首次获得机械激活的离子通道Piezo1的三维结构
doi:10.1038/nature25453

Piezo1的结构,图片来自Ward Lab。
通过采用高分辨率的低温电镜技术(cryoEM),这项新的研究表明Piezo1是由三个弯曲的“叶片(blade)”组成,这些叶片环绕着一个中心孔。这些研究人员认为这些叶片对机械力作出反应而发生移动,这会打开和关闭这个中心孔,从而让离子通过这个中心孔来发送信号,从而传达触摸。一种横梁状结构充当每个叶片的骨架。一个“锚定结构域”包围着这个中心孔,即这些叶片在中间相遇的地方。
2.Nature:揭示出人上皮细胞钙离子通道TRPV6的三维结构
doi:10.1038/nature25182
在一项新的研究中,来自美国哥伦比亚大学医学中心的研究人员首次获得一种能够让上皮细胞吸收钙离子的膜孔的详细结构图片。这一发现可能加快开发校正与乳腺癌、子宫内膜癌、前列腺癌和结肠癌存在关联的钙离子摄取异常的药物。相关研究结果于2017年12月20日在线发表在Nature期刊上,论文标题为“Opening of the human epithelial calcium channel TRPV6”。
这些研究人员采用先进的低温电镜技术来对TRPV6进行成像。通过比较通道蛋白TRPV6在打开和关闭状态下的结构,他们能够确定这种通道蛋白的核心部分---四个紧密排列的螺旋蛋白片段---发生微小的扭曲,从而允许TRPV6打开。
3.Science:解析出感知寒冷温度和薄荷醇的TRPM8蛋白结构
doi:10.1126/science.aan4325
尽管最为人所知的是,TRPM8是感知适度寒冷温度(低于约25°C)和薄荷醇等冷感分子(cold-sensation molecule)的外周神经传感器,但是它也在许多其他正常组织中甚至在身体深处发现到,不过,它在这些组织中的功能基本上还是未知的。详细理解TRPM8与它的天然结合搭档在结构上的相互作用应该导致人们开发出更好的分子探针,从而揭示出它的各种功能。
为此,在一项新的研究中,来自美国斯克里普斯研究所和杜克大学的研究人员采用低温电镜技术(cryo-EM),即一种越来越受到人们青睐的结构确定方法。他们首先从十多种不同的动物物种(包括人类、小鼠和鸟类)中筛选TRPM8蛋白,以便找到一种可能最适合用于低温电镜研究的蛋白。他们确定了来自一种被称作白领姬鹟(collared flycatcher)的鸟类物种的蛋白TRPM8。相关研究结果于2017年12月7日在线发表在Science期刊上,论文标题为“Structure of the cold- and menthol-sensing ion channel TRPM8”。论文通信作者为斯克里普斯研究所的副教授Gabriel C. Lander博士和杜克大学医学院的Seok-Yong Lee博士。论文第一作者为Lander实验室研究生Mengyu Wu和Lee实验室研究生Ying Yin。
4.Science:从结构上揭示Dicer屠杀病毒新机制
doi:10.1126/science.aaq0921

图片来自Janet Iwasa。
他们利用低温电镜技术(cryo-EM)极速冻存和分析Dicer。尽管采用了先进的方法,但是获得这种蛋白与病毒dsRNA相互作用时的图片并不容易。根据cryo-EM的标准,Dicer太小了。此外,它发生弯曲和移动,这使得人们很难确定它的结构。
这些研究人员克服了这些困难:利用生物化学方法捕捉处于特定位置的Dicer-病毒dsRNA结合物,随后获得这种结合物的几十万张图片。他们发现这种神秘的解旋酶结构域确定了一种之前未知的病毒摧毁机制:该结构域识别这种病毒,在杀死它之前,缠绕着它。重要的是,一旦这种解旋酶结构域抓住病毒dsRNA,它就不会放手,从而提高根除感染的机会。
5.Cell:揭示出与阿尔茨海默病和癌症相关的酶ADAM10的三维结构
doi:10.1016/j.cell.2017.11.014
在一项新的研究中,来自美国哈佛医学院等研究机构的研究人员揭示出ADAM10的原子结构。他们的发现描述了一种阻止类似剪刀的ADAM10随意地切割蛋白的自动防故障机制。相关研究结果发表在2017年12月14日的Cell期刊上,论文标题为“Structural Basis for Regulated Proteolysis by the α-Secretase ADAM10”。论文通信作者为哈佛医学院的Stephen Blacklow教授。论文第一作者为哈佛医学院的博士后研究员Tom Seegar。
观察ADAM10的详细形状加深了科学家们对这种分子如何正常地发挥作用的理解,并且为探究它如何发生偏差提供基础。这一发现也为开发特异性地作用于ADAM10的药物来治疗它触发的疾病奠定基础。
6.Science:首次从结构上揭示帕金森病的关键组分的毒性产生机制
doi:10.1126/science.aan6160
在一项新的研究中,来自英国、意大利和西班牙的研究人员观察到与帕金森病相关的毒性蛋白聚集物如何破坏健康的神经元的细胞膜,导致它们的细胞壁出现缺陷,最终导致一系列诱导神经元死亡的事件。相关研究结果发表在2017年12月15日的Science期刊上,论文标题为“Structural basis of membrane disruption and cellular toxicity by α-synuclein oligomers”。论文通信作者为英国帝国理工学院的Alfonso De Simone博士和剑桥大学的Christopher Dobson教授。
这项研究探究了所谓的毒性寡聚物,即当单个蛋白错误折叠并聚集在一起时出现的蛋白分子聚集物。就帕金森病而言,所涉及的蛋白是α突触核蛋白(alpha synuclein)。当α突触核蛋白发挥正常功能时,它在大脑内的信号转导中发挥着重要作用。
这些蛋白聚集物的形成和扩散被认为导致这种渐进性疾病的分子机制中的一个关键组分。理解它们如何进入和破坏细胞为开发新的更加有效的药物提供了机会。但是迄今为止,研究它们如何破坏脑细胞是比较困难的,这是因为它们通常是不稳定的。在形成后不久,它们要么土崩瓦解,要么组装成更大的对单个细胞破坏较小的结构。
在这项新的研究中,这些研究人员能够让α突触核蛋白寡聚物在足够长的时间内保持稳定以便以前所未有的细节研究它们如何破坏脑细胞。他们鉴定出这种寡聚物的一种允许它附着到细胞壁上的特异性特征和一种“结构核心”,随后便取得突破性的研究结果。
在这项新的研究中,这项研究人员在实验室中利用固态核磁共振光谱技术(solid state nuclear magnetic resonance spectroscopy, SSNMR)研究了有毒性的和无毒性的α突触核蛋白样品。这种技术近期取得的进展能够让他们以前所未有的细节研究这些蛋白寡聚物。他们描述这些寡聚物的不同特征,随后研究了这些不同的特征如何影响它们与从大鼠中提取出的脑细胞之间的相互作用,以及它们与从人脑瘤中提取出的细胞之间的相互作用。特别地,这项研究的结果可能有助鉴定出能够攻击这些破坏性的α突触核蛋白寡聚物因而对它们的影响加以限制的分子。
7.Nature:从结构上揭示出mTORC1的作用机制
doi:10.1038/nature25023
多年来,科学家们一直试图利用药物靶向异常活跃的mTORC1以作为一种治疗癌症的方法。两种这样的药物已被美国食品药品管理局(FDA)批准用于治疗某些类型的肾癌和乳腺癌。但总的来说,mTORC1靶向药物是令人失望的。这可能是因为mTORC1是一个细胞机器中的一种庞大而又复杂的亚基。这种细胞机器是由几种相互结合在一起的蛋白亚基形成的一种更大的组装体。鉴于它存在着很多相互作用的亚基,这可能很难一击命中。
如今,在一项新的研究中,在结构生物学家Nikola Pavletich的领导下,来自美国斯隆-凯特林研究所的研究人员解析出mTORC1的三维结构。他们利用一种被称作低温电镜(cryo-EM)的技术可视化它的结构,包括它在发挥作用时的三维结构。这种超高分辨率的结构信息为设计更加有效的药物来阻断这种关键的癌症促进物(即mTORC1)奠定基础。相关研究结果于2017年12月13日在线发表在Nature期刊上,论文标题为“Mechanisms of mTORC1 activation by RHEB and inhibition by PRAS40”。
这种利用cryo-EM新获得的mTORC1结构展示了所有的这些组分(如mTORC1、RHEB/ PRAS40、RAPTOR)如何结合在一起,包括mTORC1酶是如何被激活的。
8.Nature:从结构上揭示TMEM16A激活机制,有望开发出新型囊性纤维化疗法
doi:10.1038/nature24652
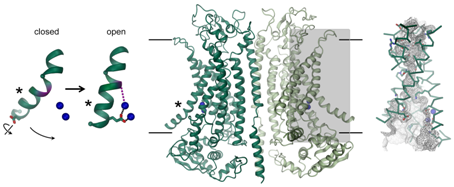
图片来自Raimund Dutzler/UZH。
上一篇:问吧精选︱人体怎样与病毒搏斗?
下一篇:宁安橡胶喷胶软管选择方法